Argon ist das am häufigsten verwendete Inertgas in Handschuhkästen und Schlenk-Linien für hochsensible Experimente. Während Stickstoff eine kostengünstigere und häufige Alternative ist, wird Argon strikt bevorzugt, wenn die Gefahr besteht, dass das "inerte" Gas mit den experimentellen Materialien reagiert, was bei bestimmten Metallen oder bei hohen Temperaturen auftreten kann.
Die Wahl zwischen Argon und Stickstoff ist eine kritische Entscheidung in der luftempfindlichen Chemie, die Kosten und chemische Reinheit abwägt. Während Stickstoff ein kostengünstiges Arbeitspferd ist, bietet Argon ein überlegenes Maß an Inertheit und dient als wesentliche Absicherung für hochreaktive oder Hochtemperaturexperimente.

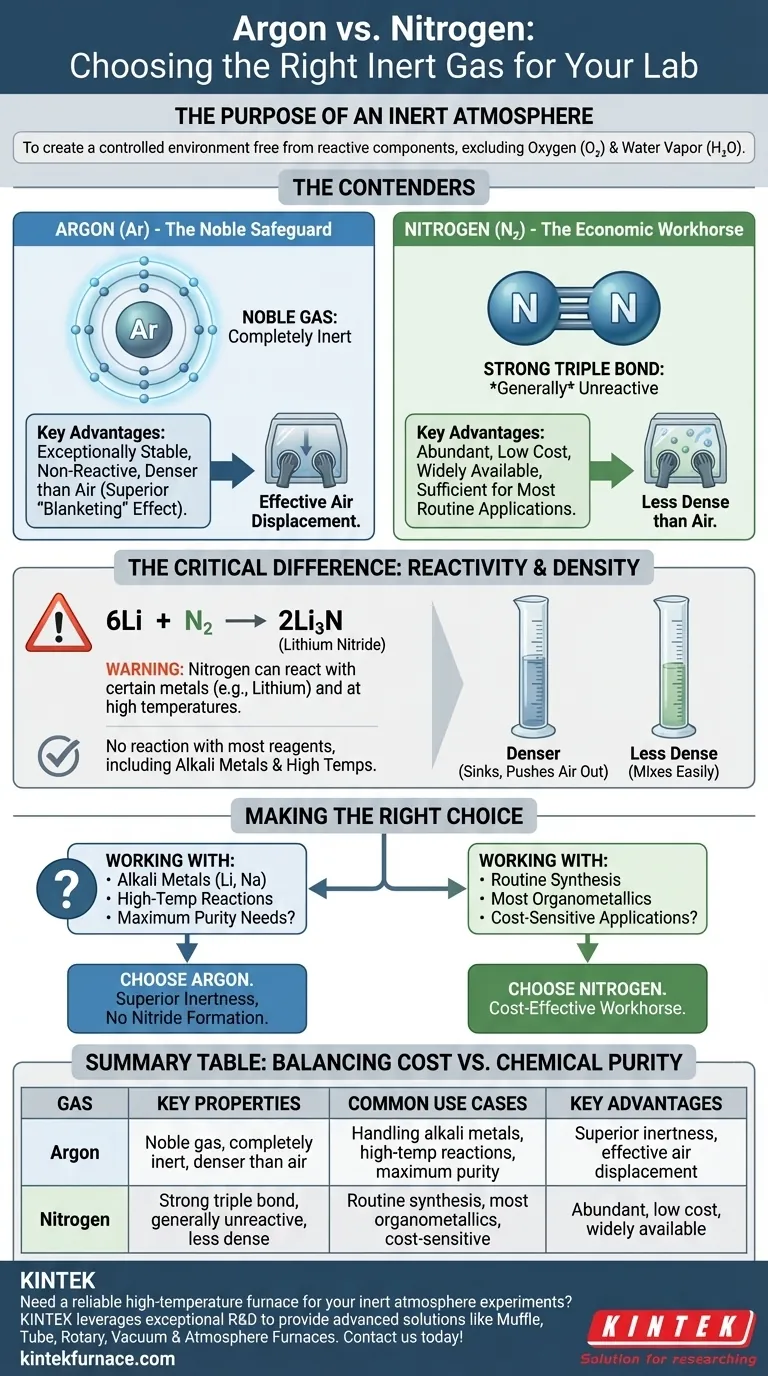
Der Zweck einer inerten Atmosphäre
Die Hauptfunktion eines Handschuhkastens oder einer Schlenk-Linie besteht darin, eine kontrollierte Umgebung zu schaffen, die frei von reaktiven atmosphärischen Komponenten ist. Die Hauptübeltäter, die Sie ausschließen möchten, sind Sauerstoff (O₂) und Wasserdampf (H₂O), die empfindliche Reagenzien und Katalysatoren leicht zersetzen können.
Ein Inertgas wie Argon oder Stickstoff wird verwendet, um die Luft zu verdrängen und einen Überdruck aufrechtzuerhalten, der jegliches Eindringen atmosphärischer Lecks in das System verhindert.
Die Konkurrenten vergleichen: Argon vs. Stickstoff
Obwohl beide zur Erzeugung einer inerten Atmosphäre verwendet werden, bestimmen ihre chemischen und physikalischen Eigenschaften, wann das eine dem anderen vorzuziehen ist.
Stickstoff: Das wirtschaftliche Arbeitstier
Stickstoff (N₂) macht etwa 78 % der Luft aus, die wir atmen, und ist daher reichlich vorhanden und preiswert.
Das N₂-Molekül zeichnet sich durch eine sehr starke Dreifachbindung zwischen seinen beiden Stickstoffatomen aus. Diese Bindung erfordert eine erhebliche Energiemenge, um sie zu brechen, weshalb Stickstoff im Allgemeinen unreaktiv und für eine Vielzahl chemischer Anwendungen geeignet ist.
Argon: Der edle Schutz
Argon (Ar) ist ein Edelgas. Das bedeutet, dass seine Atome eine vollständig gefüllte äußere Elektronenschale haben, was es außergewöhnlich stabil und nicht reaktiv macht.
Unter praktisch allen Laborbedingungen wird Argon keine chemischen Bindungen eingehen oder mit Ihren Reagenzien reagieren. Diese fundamentale chemische Inertheit ist seine größte Stärke.
Der entscheidende Unterschied: Reaktivität
Der Begriff "inert" ist relativ. Obwohl Stickstoff meist unreaktiv ist, ist er nicht vollständig inert.
Unter bestimmten Bedingungen kann Stickstoff mit bestimmten Metallen reagieren und Metallnitride bilden. Das häufigste Beispiel in der synthetischen Chemie betrifft Lithiummetall, das schon bei Raumtemperatur bereitwillig mit N₂-Gas reagiert, um Lithiumnitrid (Li₃N) zu bilden.
6Li + N₂ → 2Li₃N
Diese unerwünschte Nebenreaktion kann Ihr Reagenz verbrauchen und Verunreinigungen einführen. Ähnliche Reaktionen können mit anderen Alkalimetallen, Erdalkalimetallen oder während Synthesen bei hohen Temperaturen auftreten. Argon hat als Edelgas diese Anfälligkeit nicht.
Eine praktische Überlegung: Gasdichte
Ein wichtiger physikalischer Unterschied ist die Dichte. Argon ist etwa 40 % dichter als Luft, während Stickstoff etwas weniger dicht ist als Luft.
Das bedeutet, dass Argon Luft effektiver aus einem Behälter verdrängt, da es "sinkt" und die leichtere Luft nach oben und hinausdrückt. Dieser "Blanketing"-Effekt macht es überlegen zum Spülen von Glasgeräten an einer Schlenk-Linie und zur Aufrechterhaltung einer stabilen Atmosphäre in einem Handschuhkasten, da es sich am Boden absetzt, anstatt sich leicht zu mischen.
Die Kompromisse verstehen
Die Wahl des richtigen Gases erfordert ein Abwägen zwischen absoluter Sicherheit und praktischen Einschränkungen.
Kosten: Der Hauptfaktor
Der größte Vorteil von Stickstoff sind seine geringen Kosten. Argon ist wesentlich teurer als Stickstoff.
Für Labore, die viele Handschuhkästen betreiben oder große Synthesen durchführen, kann dieser Kostenunterschied ein wesentlicher Faktor sein. Aus diesem Grund ist Stickstoff oft die Standardwahl für Arbeiten, bei denen seine potenzielle Reaktivität kein Problem darstellt.
Reinheit und Versorgung
Beide Gase sind kommerziell in sehr hohen Reinheitsgraden erhältlich (z. B. 99,999 %). Der Hauptunterschied liegt oft in der Versorgungsmethode.
Große Stickstoffverbraucher verfügen möglicherweise über eigene Generatoren oder große Flüssigstickstoff-Dewar-Gefäße, die eine kontinuierliche Gasversorgung durch Verdampfung ermöglichen, was die Betriebskosten weiter senkt. Argon wird fast immer in Hochdruckgasflaschen geliefert, die regelmäßig ausgetauscht werden müssen.
Die richtige Wahl für Ihr Experiment treffen
Ihre Entscheidung sollte auf der spezifischen Chemie basieren, die Sie durchführen.
- Wenn Ihr Hauptaugenmerk auf routinemäßiger Synthese, Reinigung oder dem Umgang mit den meisten Organometallen liegt: Verwenden Sie Stickstoff. Er ist für die überwiegende Mehrheit der Anwendungen ausreichend inert und bietet erhebliche Kosteneinsparungen.
- Wenn Ihr Hauptaugenmerk auf der Arbeit mit Lithium, anderen Alkalimetallen oder der Durchführung von Hochtemperaturreaktionen liegt: Verwenden Sie Argon. Seine überlegene Inertheit ist unerlässlich und schützt Ihr Experiment vor der Bildung unerwünschter Metallnitride.
- Wenn Ihr Hauptaugenmerk auf maximaler Sicherheit und der Eliminierung aller Variablen liegt: Verwenden Sie Argon. Die höheren Kosten sind ein kleiner Preis für die Gewissheit, dass Ihr Inertgas wirklich inert ist.
Letztendlich ist es das Verständnis der subtilen Reaktivität von Stickstoff, das routinemäßige Praxis von präzisem und überlegtem experimentellem Design unterscheidet.
Zusammenfassungstabelle:
| Gas | Schlüsseleigenschaften | Häufige Anwendungsfälle | Wesentliche Vorteile |
|---|---|---|---|
| Argon | Edelgas, völlig inert, dichter als Luft | Umgang mit Alkalimetallen, Hochtemperaturreaktionen, maximale Reinheitsanforderungen | Überlegene Inertheit, effektive Luftverdrängung, keine Nitridbildung |
| Stickstoff | Starke Dreifachbindung, allgemein unreaktiv, weniger dicht als Luft | Routinemäßige Synthese, die meisten Organometalle, kostenempfindliche Anwendungen | Reichlich vorhanden, kostengünstig, weit verbreitet |
Benötigen Sie einen zuverlässigen Hochtemperaturofen für Ihre Experimente unter inerter Atmosphäre? KINTEK nutzt außergewöhnliche Forschung und Entwicklung sowie eigene Fertigung, um fortschrittliche Lösungen wie Muffel-, Rohr-, Dreh-, Vakuum- und Atmosphärenöfen sowie CVD/PECVD-Systeme anzubieten. Mit starken tiefgreifenden Anpassungsmöglichkeiten erfüllen wir Ihre einzigartigen experimentellen Anforderungen präzise. Kontaktieren Sie uns noch heute, um die Effizienz und Sicherheit Ihres Labors zu verbessern!
Visuelle Anleitung
Ähnliche Produkte
- 1200℃ Kontrollierter Ofen mit Stickstoffatmosphäre
- Mesh Belt Ofen mit kontrollierter Atmosphäre Ofen mit inerter Stickstoffatmosphäre
- 1700℃ Gesteuerter Ofen mit inerter Stickstoffatmosphäre
- 1400℃ Gesteuerter Ofen mit inerter Stickstoffatmosphäre
- Ofen mit kontrollierter inerter Stickstoff-Wasserstoff-Atmosphäre
Andere fragen auch
- Was ist der Hauptzweck der Wärmebehandlung? Metallische Eigenschaften für überlegene Leistung umwandeln
- Wie funktioniert die Wärmebehandlung in inerter Atmosphäre? Oxidation verhindern für überlegene Materialqualität
- Wofür wird Stickstoff in einem Ofen verwendet? Oxidation verhindern und Qualität der Wärmebehandlung steuern
- Wie funktioniert eine chemisch inerte Atmosphäre in einem Ofen? Oxidation verhindern und Materialreinheit gewährleisten
- Was ist der Nutzen von Stickstoff im Ofen? Verhinderung von Oxidation für eine überlegene Wärmebehandlung



















